專題一、弱電解質(zhì)的電離
專題一、弱電解質(zhì)的電離
一、電解質(zhì)和非電解質(zhì)
1、概念
電解質(zhì):
在水溶液里或熔融狀態(tài)下能導(dǎo)電的化合物
非電解質(zhì):
在水溶液里和熔融狀態(tài)下都不導(dǎo)電的化合物
2、電解質(zhì)與非電解質(zhì)本質(zhì)區(qū)別:在一定條件下(溶于水或熔化)能否電離(以能否導(dǎo)電來證明是否電離)
3、強(qiáng)電解質(zhì)和弱電解質(zhì)根據(jù)電解質(zhì)在水溶液里是否全部電離,把電解質(zhì)分為強(qiáng)電解質(zhì)和弱電解質(zhì)。
強(qiáng)電解質(zhì):在水溶液中能夠全部電離的電解質(zhì)為強(qiáng)電解質(zhì)。
弱電解質(zhì):在水溶液中只有部分電離的電解質(zhì)為弱電解質(zhì)。
常見的強(qiáng)電解質(zhì)有:強(qiáng)酸、強(qiáng)堿和絕大多數(shù)鹽
常見的弱電解質(zhì)有:弱酸、弱堿、水和極少多數(shù)的鹽(如醋酸鉛)
注意
(1)電解質(zhì)和非電解質(zhì)的范疇都是化合物(純凈物)
(2)電解質(zhì)——離子化合物或共價化合物離子型的電解質(zhì)在水溶液中或熔融狀態(tài)下都可以導(dǎo)電,如氯化鈉;而共價型的電解質(zhì)只有在水溶液中才能導(dǎo)電,如硫酸。
常見的電解質(zhì)有酸、堿、鹽、水、離子型氧化物。
非電解質(zhì)——共價化合物常見的非電解質(zhì)有蔗糖、酒精、四氯化碳等(3)金屬單質(zhì)既不是電解質(zhì),也不是非電解質(zhì)。
(4)SO,、NH3、CO,等溶于水后,溶液可以導(dǎo)電,但他們屬于非電解質(zhì)(電解質(zhì)為H2SO3等)
(5)強(qiáng)電解質(zhì)不一定是易溶于水的化合物(如BaSO,不溶于水,但溶于水的BaSO,全部電離,故BaSO,為強(qiáng)電解質(zhì))易溶于水的電解質(zhì)不一定是強(qiáng)電解質(zhì)(如CH3COOH)
(6)強(qiáng)電解質(zhì)全部電離,在溶液中全部以離子形式存在;弱電解質(zhì)部分電離,溶液中既有未電離的分子,也有已電離出的離子。
二、弱電解質(zhì)的電離1.電離平衡定義:
在一定條件下,當(dāng)弱電解質(zhì)分子電離成離子的速率和離子結(jié)合成分子的速率相等時,電離過程就達(dá)到了平衡狀態(tài),這叫做電離平衡。
◆V弱電解質(zhì)電離成離子的速率=V離
子重新結(jié)合成分子的速率
◆溶液中弱電解質(zhì)的分子和離子
的濃度保持不變
2.電離平衡的特征
逆、等、動、定、變
3.電離方程式的書寫方法
◆弱電解質(zhì)電離是可逆的,用
◆多元弱酸分步電離,以第一步為主。
◆多元弱堿一步電離(中學(xué)階段)
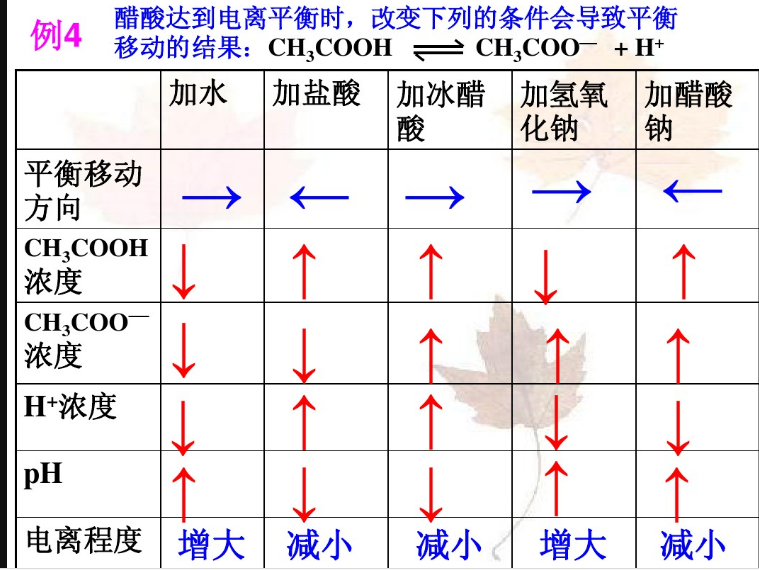
4.弱電解質(zhì)電離平衡的移動(1)弱電解質(zhì)的電離平衡符合勒夏特列原理(2)影響弱電解質(zhì)電離平衡的因素有:
以醋酸為例
①溫度:升溫,將促進(jìn)電離
②濃度
A加水稀釋將促進(jìn)電離B加入與弱電解質(zhì)具有相同離子的強(qiáng)電解質(zhì),將抑制_電離c加入能反應(yīng)的物質(zhì),將促進(jìn)電離
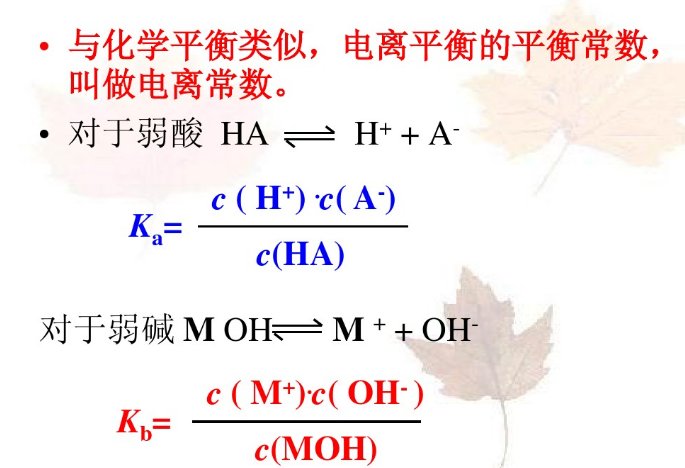
5、電離平衡常數(shù)
(1)概念:在一定條件下,弱電解質(zhì)在達(dá)到電離平衡時,溶液中電離生成的各種離子濃度的乘積跟溶液中未電離的分子濃度的比是一個常數(shù),這個常數(shù)叫電離平衡常數(shù)。
(2)電離常數(shù)的意義:根據(jù)電離常數(shù)的大小,可以估算弱電解質(zhì)電離的趨勢。K值越大,電離程度越大。
(3)K只與溫度有關(guān),不隨濃度改變而改變。
6、電離度的概念及其影響因素(1)電離度的概念
當(dāng)弱電解質(zhì)在溶液里達(dá)到電離平衡時,已電離的電解質(zhì)分?jǐn)?shù)占原來總分子數(shù)(包括已電離的和未電離的)的百分?jǐn)?shù),叫電離度。
(2)影響電離度的主要因素(內(nèi)因)是電解質(zhì)本身的性質(zhì);
(外因)主要是溶液的濃度和溫度溶液越稀,弱電解質(zhì)的電離度越大;溫度升高,電離度增天

四、溶液的pH
1、溶液pH的意義:表示溶液酸、堿性的強(qiáng)弱。
2、溶液pH的表示:
用H+物質(zhì)的量濃度的負(fù)對數(shù)來表示。
pH=-log{c(H)
如果某溶液c(H)=m×10mol/L,那么,該溶液的pH=n-logm。

①pH試紙的種類
常用的pH試紙有廣泛pH試紙和精密pH試紙
②pH試紙的pH范圍
廣泛pH試紙的pH范圍一般是1~14,可以識別的PH差值約為1;精密pH試紙范圍較窄,可以識別0.2或0.3的pH差值。
③pH試紙的使用方法取一片pH試紙,放在潔凈的表面皿或玻璃片上,用玻璃棒蘸取待測液點在試紙中部,然后與標(biāo)準(zhǔn)比色卡對照讀數(shù)。
有關(guān)pH的計算——溶液的稀釋
2、堿的稀釋(關(guān)鍵:抓住氫氧根離子進(jìn)行計算!)
*在25℃時,pH=9的NaOH溶液稀釋到10倍,pH值等于多少?
[OH-]=10-5/10~10-6
pH=-1g[H+]=-lgKw/lOH-]=-1g10-8=8
*在25℃時,pH=9的NaOH溶液稀釋到1000倍后,pH值為多少?
*向100mL純水中加入1滴(0.05mL)0.2mol/LBa(OH),溶液,pH變?yōu)槎嗌倭耍縫H=9
*pH=11的氨水稀釋到pH=10,則NHH,0的電離平衡向正向方向移動,所得氨水的物質(zhì)的量濃度小于(填大于、小于或等于)原溶液濃度的1/10。