第一章緒論
授課內(nèi)容
·引言
催化作用的意義,催化作用與熱力學(xué)
·催化作用與催化劑的定義、概念
·催化劑的重要性質(zhì)·催化劑的一般組成
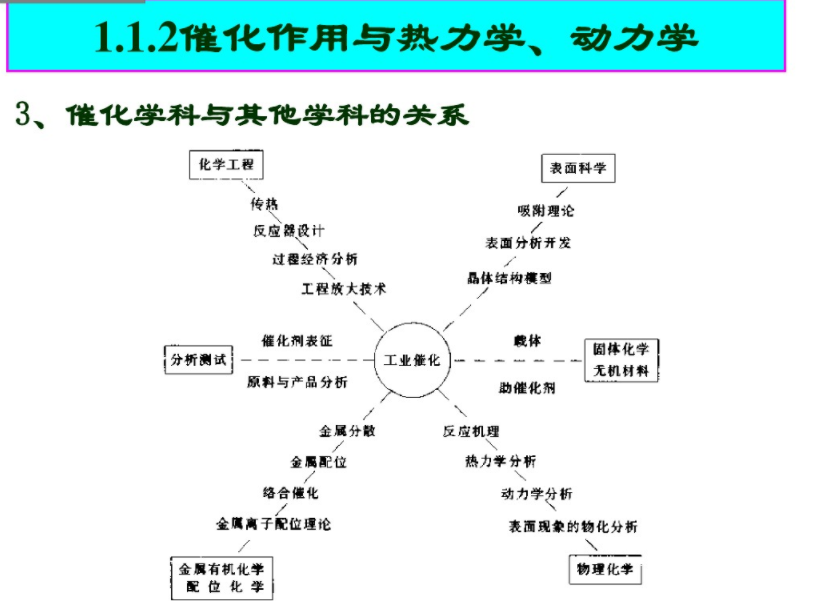
·催化體系的分類·催化科學(xué)的發(fā)展·催化科學(xué)的范圍
1.1引言
1.1.1催化作用的意義
1、催化劑在國計民生中的作用催化劑一現(xiàn)代化學(xué)工業(yè)的基石,現(xiàn)代化學(xué)工業(yè)的心臟
現(xiàn)代化學(xué)工業(yè)過程:
·據(jù)統(tǒng)計,現(xiàn)有90%以上的化工過程是采用催化劑進行生產(chǎn)的。借助于催化劑生產(chǎn)的產(chǎn)品總值在全世界工業(yè)生產(chǎn)總值中約占18%,僅低于機械產(chǎn)品的總值
·催化劑直接銷音額~100億美元/年
·催化劑消耗量>100萬噸/年
·產(chǎn)生的產(chǎn)品價值>10000億美元/年
1.1.1催化作用的意義
2、催化劑的應(yīng)用領(lǐng)域
(1)合成氨及合成甲醇:產(chǎn)量最大的合成化學(xué)品
(2)石油煉制與合成燃料:運輸量和消費量最大的化學(xué)品
(3)無機化學(xué)工業(yè):酸、堿、鹽,硫酸和硝酸的生產(chǎn)(4)基本有機合成工業(yè):醇、醛(酮)、酸、酯、晴(5)三大合成材料:合成樹脂與塑料、合成橡膠、合成纖維Ziegler-Natta、后過渡金屬、茂金屬催化劑(6)精細化工產(chǎn)品:品種最多、平均單價高的化學(xué)品(7)生物化工:最有潛力和發(fā)展前景的化工領(lǐng)城
(8)環(huán)境化學(xué):與人類生存密切相關(guān)的領(lǐng)域,尾氣凈化

1.1.1催化作用的意義3、自然界
生物界:一切生命活動都商不開酶催化地質(zhì):地質(zhì)催化,如:石油生成的催化作用日常生活:空氣凈化
1.1.2催化作用與熱力學(xué)、動力學(xué)1、化學(xué)反應(yīng)體系實現(xiàn)的2個基本要素
·熱力學(xué)可行性:反應(yīng)能否進行、進行的程度熱力學(xué)平衡:化學(xué)反應(yīng)的極限,反應(yīng)的方向
·動力學(xué)可能性:反應(yīng)進行的速度、何時達到平衡2者缺一不可
1.1.2催化作用與熱力學(xué)、動力學(xué)2、催化劑的作用
(1)加快反應(yīng)速度
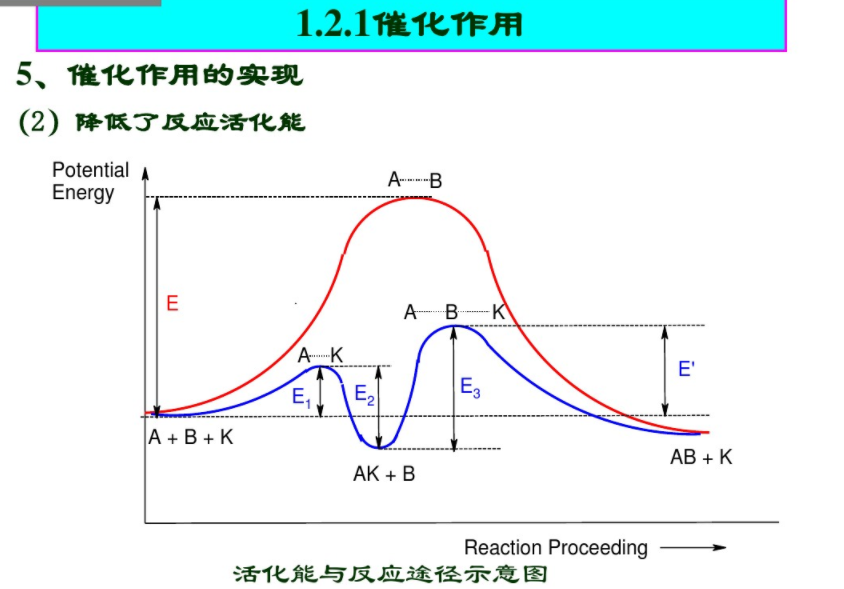
催化劑能改變反應(yīng)途徑,降低反應(yīng)活化能催化只能加快熱力學(xué)可行的反應(yīng)速度不能改變反應(yīng)平衡常數(shù)
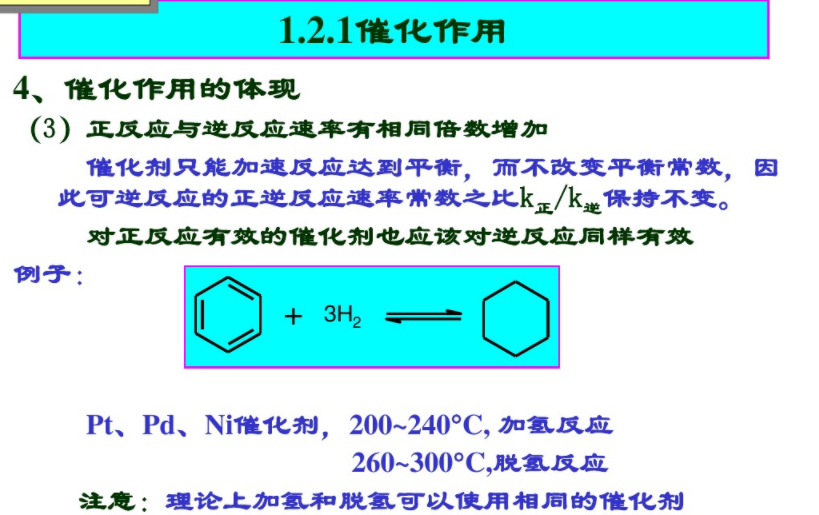
正反應(yīng)和逆反應(yīng)同樣加速
只能加快熱力學(xué)上可行的反應(yīng),“催化不是萬能的”
(2)提高選擇性
改變反應(yīng)歷程
降低反應(yīng)活化能
加快主要反應(yīng)速度
1.2催化作用與催化劑
1.2.1催化作用
1、催化作用早期的歷史
·最早的催化一Biocatalysis:中國,公元前,發(fā)酵一釀酒、制醋、醬和醬油制做、侵頭和面包制做等
·非生物催化
一1740年,英國,Ward,硝酸鉀促進硫磺的燃燒反應(yīng)一1781年,法國,Parmentier,硫酸促進淀粉水解一1816年,英國,Davy,鉑促進甲婉和醇的氧化反應(yīng)一1820年,視國,Dobereiner,鉑粉促進氫氣和氧氣的化合(化學(xué)演示反應(yīng))特點:只是有意識地應(yīng)用了催化作用,并不知道催化作用,并未提出“催化”
1.2.1催化作用4、催化作用的體現(xiàn)
(1)只加速熱力學(xué)上可行的反應(yīng)催化劑只能加速熱力學(xué)可行的反應(yīng),而不能實現(xiàn)熱力學(xué)不可能的反應(yīng)。
(2)催化劑不影響平衡常數(shù)
反應(yīng)終了時催化劑的化學(xué)性質(zhì)沒有改變,不會影響反應(yīng)體系的標準自由能變化AG0,因而也不會影響平衡常數(shù)K。與此相反,若一種物質(zhì)加入后使反應(yīng)體系的AG0改變,則不能看作是催化劑。
1.2.1催化作用
7、催化反應(yīng)中的催化劑
(2)催化劑用量少且不消耗
催化劑在反應(yīng)過程完成后并不消耗
少量催化劑可以催化大量反應(yīng)物
特效催化劑:酶催化和有機金屬催化催化劑濃度在10-6-9數(shù)量級(3)化學(xué)計量方程式與催化劑量無關(guān),反應(yīng)速度與催化劑量成正比
(4)參加反應(yīng)后催化劑會有變化但很微小催化劑組成、結(jié)構(gòu)和孔結(jié)構(gòu)的緩慢變化催化劑與反應(yīng)物和產(chǎn)物的元素交換
活性組份的微小變化
其他派生反應(yīng)—一催化劑緩慢失活的原因
1.2.2催化劑的重要性質(zhì)評價催化劑的四個最重要的性質(zhì)(指標):
(1)活性,Activity,高(2)選擇性,Selectivity,高(3)壽命,Lifetime,長(4)價格,Cost,低
1.2.2催化劑的重要性質(zhì)
1、催化劑的活性
(1)活性的表示方法:活性高醫(yī)表示催化劑對反應(yīng)加速的強弱,表示催化劑活性的方法很多,通常有以下幾種方法:
A)轉(zhuǎn)換頻率,turnover frequency/s-1:在給突反應(yīng)條件及一定反應(yīng)程度下,單位時間內(nèi)每個活性位上發(fā)生的總包反應(yīng)次數(shù)。這是催化活性的本質(zhì)表示,非常科學(xué)。但由于催化活性位的組成、結(jié)構(gòu)和數(shù)量難以確定,實際上難以實現(xiàn),只限于理論研究
1.2.2催化劑的重要性質(zhì)1、催化劑的活性
B)反應(yīng)速率:反應(yīng)速率表示反應(yīng)的快慢,不同場合使用不同速率表示法。在多數(shù)情況下,以反應(yīng)物消失的速率或以產(chǎn)物生成的速率表示反應(yīng)的快慢。

1.2.2催化劑的重要性質(zhì)1、催化劑的活性
·在氣固多相催化反應(yīng)使用固體催化劑情況下,Q可以是催化劑的體積(單位體積的反應(yīng)速率,V)、質(zhì)量(反應(yīng)的比速率,m)或表面積(單位面積的反應(yīng)速率,A)
·在均相催化時,Q是反應(yīng)體系的體積
√用速率比較催化劑的活性時,應(yīng)保證反應(yīng)進行時的溫度、壓力和原料氣的組成相同工業(yè)上常用時空收率表示催化劑的活性。其定義是每小時每升催化劑所得產(chǎn)物量。它是一段時間內(nèi)速率的平均值。雖然這種表示活性的方法不精確,但較實用
1.2.2催化劑的重要性質(zhì)
1、催化劑的活性
C)速率常數(shù):用速率常數(shù)比較活性時,要求溫度相同,在不同催化劑上反應(yīng),僅當反應(yīng)的速率方程有相同的形式時,用速率常數(shù)比較活性大小才有意義
D)轉(zhuǎn)化率:這也是常用的比較催化劑活性的參量。
轉(zhuǎn)化率定義為:X=反應(yīng)物轉(zhuǎn)化量/引入體系的反應(yīng)物總量*100%
在用轉(zhuǎn)化速率比較活性時:要求反應(yīng)溫度,壓力、原料氣濃度和接觸時間(停留時間)相同
·若為一級反應(yīng),由于轉(zhuǎn)化率與反應(yīng)物濃度無關(guān),則不要求原料氣濃度相同的條件