- 1.1.1.1 理想氣體狀態(tài)方程與分壓定律(Av44506930,P1)
- 2.1.1.2 實際氣體(Av44506930,P2)
- 3.1.2 等離子體(Av44506930,P3)
- 4.2.1.1 系統(tǒng)與環(huán)境(Av44506930,P4)
- 5.2.1.2 聚集狀態(tài)與相(Av44506930,P5)
- 6.2.1.3 系統(tǒng)狀態(tài)與狀態(tài)函數(shù)(Av44506930,P6)
- 7.2.1.4 過程與途徑(Av44506930,P7)
- 8.2.1.5 熱和功(Av44506930,P8)
- 9.2.1.6 熱力學能(Av44506930,P9)
- 10.2.2.1 反應(yīng)熱(Av44506930,P10)
- 11.2.2.2 熱力學標準態(tài)(Av44506930,P11)
- 12.2.2.3 熱化學方程式(Av44506930,P12)
- 13.2.2.4 Hess定律(Av44506930,P13)
- 14.2.2.5 物質(zhì)的標準摩爾生成焓(Av44506930,P14)
- 15.2.2.6 利用物質(zhì)的標準摩爾生成焓計算反應(yīng)熱(Av44506930,P15)
- 16.2.2.7 標準摩爾燃燒焓、用標準摩爾燃燒焓計算反應(yīng)熱(Av44506930,P16)
- 17.2.3.1 化學反應(yīng)的自發(fā)過程(Av44506930,P17)
- 18.2.3.2 影響化學反應(yīng)方向的因素-焓變(Av44506930,P18)
- 19.2.3.3 影響化學反應(yīng)方向的因素-熵變、溫度(Av44506930,P19)
- 20.2.3.4 化學反應(yīng)的吉布斯自由能變--化學反應(yīng)方向的判據(jù)(Av44506930,P20)
- 21.2.3.5 化學反應(yīng)的標準摩爾吉布斯自由能變的計算(Av44506930,P21)
- 22.2.3.6 用反應(yīng)的標準摩爾焓變和標準摩爾熵變算反應(yīng)自發(fā)的溫度(Av44506930,P22)
- 23.2.4.1 化學反應(yīng)的限度--化學平衡(Av44506930,P23)
- 24.3.1 化學反應(yīng)速率及其表示方法(Av44506930,P24)
- 25.3.2.1 濃度與反應(yīng)速率(一)(Av44506930,P25)
- 26.3.2.2 濃度與反應(yīng)速率(二)(Av44506930,P26)
- 27.3.3 溫度對反應(yīng)速率的影響(Av44506930,P27)
- 28.3.4 反應(yīng)的活化能(Av44506930,P28)
- 29.3.2.5 催化劑與反應(yīng)速率(Av44506930,P29)
- 30.4.1 分散系統(tǒng)和溶液(Av44506930,P30)
- 31.4.2.1 稀溶液的蒸氣壓下降(Av44506930,P31)
- 32.4.2.2 稀溶液的沸點升高和凝固點降低(Av44506930,P32)
- 33.4.2.3 稀溶液的滲透壓(Av44506930,P33)
- 34.4.2.4 依數(shù)性理論的局限(Av44506930,P34)
- 35.4.3.1 弱電解質(zhì)的解離平衡(Av44506930,P35)
- 36.4.3.2 共同離子效應(yīng)(Av44506930,P36)
- 37.4.3.3 緩沖溶液(Av44506930,P37)
- 38.4.4.1 溶度積和溶解度(Av44506930,P38)
- 39.4.4.2 溶度積規(guī)則(Av44506930,P39)
- 40.4.4.3 多相離子平衡的移動(Av44506930,P40)
- 41.4.5 表面活性劑(Av44506930,P41)
- 42.5.4.3 電極上放電反應(yīng)的一般規(guī)律(Av44506930,P42)
- 43.6.1.1 早期的原子結(jié)構(gòu)模型(Av44506930,P43)
- 44.6.1.2 玻爾的氫原子理論(Av44506930,P44)
- 45.6.2.1 微觀粒子的運動特征(Av44506930,P45)
- 46.6.2.2 主量子數(shù)和角量子數(shù)(Av44506930,P46)
- 47.6.2.3 磁量子數(shù)和自旋量子數(shù)(Av44506930,P47)
- 48.6.2.4 波函數(shù)的圖形描述(Av44506930,P48)
- 49.6.2.5 電子云的角度分布圖(Av44506930,P49)
- 50.6.2.6 電子云的徑向分布圖(Av44506930,P50)
- 51.6.3.1 多電子原子軌道能級(Av44506930,P51)
- 52.6.3.2 屏蔽效應(yīng)和鉆穿效應(yīng)(Av44506930,P52)
- 53.6.3.3 核外電子排布規(guī)則(Av44506930,P53)
- 54.6.3.4 :原子的電子層結(jié)構(gòu)和元素周期表(Av44506930,P54)
- 55.6.3.5 原子半徑的周期性(Av44506930,P55)
- 56.6.3.6 電離能和電子親和能的周期性變化(Av44506930,P56)
- 57.6.3.7 電負性的周期性(Av44506930,P57)
- 58.6.4.1 化學鍵的電子理論(Av44506930,P58)
- 59.6.4.2 現(xiàn)代價健理論(Av44506930,P59)
- 60.6.4.3 共價鍵的類型(Av44506930,P60)
- 61.6.4.4 雜化軌道理論(Av44506930,P61)
- 62.6.4.5 sp和sp2雜化(Av44506930,P62)
- 63.7.1 過渡元素的通性(Av44506930,P63)
- 64.7.2.1 鉻族元素的概述(Av44506930,P64)
- 65.7.2.2 鉻的重要化合物(一)(Av44506930,P65)
- 66.7.2.3 鉻的重要化合物(二)(Av44506930,P66)
- 67.7.3 錳族元素及其化合物(Av44506930,P67)
- 68.8.1.1 配合物的組成和基本概念(Av44506930,P68)
- 69.8.1.2 配位數(shù)的影響因素與命名(Av44506930,P69)
- 70.8.2.1 配合物的價鍵理論與配離子的空間構(gòu)型(一)(Av44506930,P70)
- 71.8.2.2 配合物的價鍵理論與配離子的空間構(gòu)型(二)(Av44506930,P71)
- 72.8.3 配離子的解離平衡(Av44506930,P72)
- 73.8.4 幾種類型的配合物(Av44506930,P73)
- 74.8.5 配合物的應(yīng)用(Av44506930,P74)
- 75.9.1 材料的分類及常用工程材料在周期系中的分布(Av44506930,P75)
- 76.9.2 形狀記憶合金與貯氫合金(Av44506930,P76)
- 77.9.3 精細陶瓷與納米陶瓷(Av44506930,P77)
- 78.9.4 有機高分子材料(Av44506930,P78)
- 79.9.5 復(fù)合材料(Av44506930,P79)
- 80.9.6 液晶材料(Av44506930,P80)
- 81.10.1 氨基酸與蛋白質(zhì)(Av44506930,P81)
- 82.10.2 酶與生物催化(Av44506930,P82)
- 83.10.3 核酸(Av44506930,P83)
- 84.10.4 糖類(Av44506930,P84)
- 85.10.5 脂類(Av44506930,P85)
- 86.10.6 微量元素與人體健康(Av44506930,P86)
- 87.10.7 食品安全(Av44506930,P87)
大學化學mooc(天津大學)
第1章物質(zhì)結(jié)構(gòu)基礎(chǔ)
1.1原子結(jié)構(gòu)及核外電子的排布
1、微觀粒子的特性粒二象性運動的統(tǒng)計性

第2章化學反應(yīng)的能量關(guān)系
2.1基本概念
系統(tǒng)與環(huán)境
狀態(tài)—→標準狀態(tài)
狀態(tài)函數(shù)及性質(zhì)——強度性質(zhì)和容量性質(zhì)狀態(tài)變化—過程只確定于始態(tài)與終態(tài),與途徑無關(guān)
2.2熱力學第一定理
1、內(nèi)能U熱力學能
系統(tǒng)內(nèi)部的原子和分子的各種形式能量的總和。
包括:分子振動、轉(zhuǎn)動能;分子內(nèi)原子的作用能—鍵能;電子的能量;質(zhì)子運動的平動能;核內(nèi)粒子間的作用能——核能.
3、焙H大多數(shù)過程都伴有P,V變化,故定義:
H=U+PV同樣焙是狀態(tài)函數(shù),無法獲得絕對值,只需求焙變AH.
4、焙變AH的計算
焙變AH在數(shù)值上等與可逆過程的熱效應(yīng)AH=Q可標準生成熱(焙),ArH9標準燃燒熱(焙),△.He


第3章化學平衡和化學反應(yīng)速率
3.1、化學平衡


3.2、化學反應(yīng)速率
化學反應(yīng)速率的表示——反應(yīng)進度
影響化學反應(yīng)速率的因素

第4章溶液
4.1單相離子平衡
1、稀溶液的通性(依數(shù)性)只取決于溶質(zhì)的粒子數(shù)


3、溶度積規(guī)則——比較J與kOsp的大小
4、溶度積的應(yīng)用
沉淀的生成、沉淀的溶解、沉淀的轉(zhuǎn)化
4.3配位平衡
1.基本概念配合物的組成配合物的命名
2.配離子的離解平衡
第5章電化學基礎(chǔ)
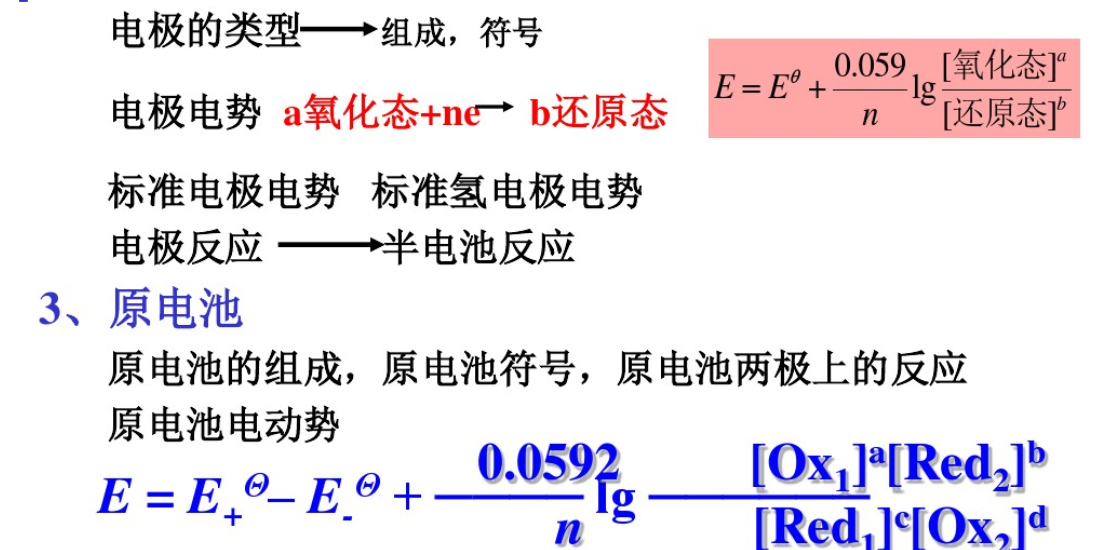
1、氧化數(shù),氧化環(huán)原反應(yīng)的配平,半反應(yīng),還原電對。
2、電極