大學(xué)化學(xué)mooc(天津大學(xué))
第1章物質(zhì)結(jié)構(gòu)基礎(chǔ)
1.1原子結(jié)構(gòu)及核外電子的排布
1、微觀粒子的特性粒二象性運動的統(tǒng)計性

第2章化學(xué)反應(yīng)的能量關(guān)系
2.1基本概念
系統(tǒng)與環(huán)境
狀態(tài)—→標(biāo)準(zhǔn)狀態(tài)
狀態(tài)函數(shù)及性質(zhì)——強度性質(zhì)和容量性質(zhì)狀態(tài)變化—過程只確定于始態(tài)與終態(tài),與途徑無關(guān)
2.2熱力學(xué)第一定理
1、內(nèi)能U熱力學(xué)能
系統(tǒng)內(nèi)部的原子和分子的各種形式能量的總和。
包括:分子振動、轉(zhuǎn)動能;分子內(nèi)原子的作用能—鍵能;電子的能量;質(zhì)子運動的平動能;核內(nèi)粒子間的作用能——核能.
3、焙H大多數(shù)過程都伴有P,V變化,故定義:
H=U+PV同樣焙是狀態(tài)函數(shù),無法獲得絕對值,只需求焙變AH.
4、焙變AH的計算
焙變AH在數(shù)值上等與可逆過程的熱效應(yīng)AH=Q可標(biāo)準(zhǔn)生成熱(焙),ArH9標(biāo)準(zhǔn)燃燒熱(焙),△.He


第3章化學(xué)平衡和化學(xué)反應(yīng)速率
3.1、化學(xué)平衡


3.2、化學(xué)反應(yīng)速率
化學(xué)反應(yīng)速率的表示——反應(yīng)進度
影響化學(xué)反應(yīng)速率的因素

第4章溶液
4.1單相離子平衡
1、稀溶液的通性(依數(shù)性)只取決于溶質(zhì)的粒子數(shù)


3、溶度積規(guī)則——比較J與kOsp的大小
4、溶度積的應(yīng)用
沉淀的生成、沉淀的溶解、沉淀的轉(zhuǎn)化
4.3配位平衡
1.基本概念配合物的組成配合物的命名
2.配離子的離解平衡
第5章電化學(xué)基礎(chǔ)
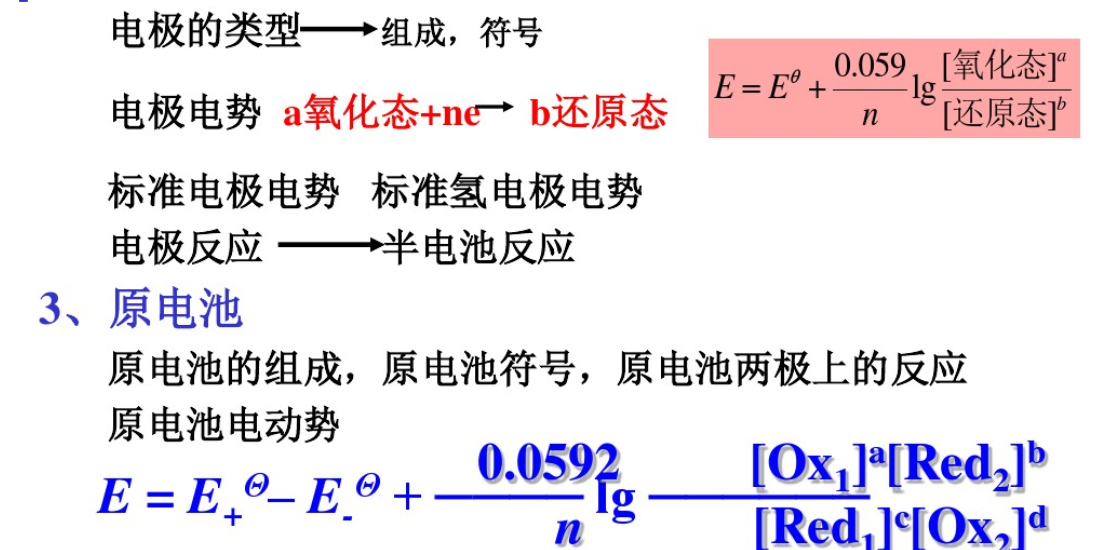
1、氧化數(shù),氧化環(huán)原反應(yīng)的配平,半反應(yīng),還原電對。
2、電極