大學化學mooc(天津大學)
第1章物質(zhì)結構基礎
1.1原子結構及核外電子的排布
1、微觀粒子的特性粒二象性運動的統(tǒng)計性

第2章化學反應的能量關系
2.1基本概念
系統(tǒng)與環(huán)境
狀態(tài)—→標準狀態(tài)
狀態(tài)函數(shù)及性質(zhì)——強度性質(zhì)和容量性質(zhì)狀態(tài)變化—過程只確定于始態(tài)與終態(tài),與途徑無關
2.2熱力學第一定理
1、內(nèi)能U熱力學能
系統(tǒng)內(nèi)部的原子和分子的各種形式能量的總和。
包括:分子振動、轉(zhuǎn)動能;分子內(nèi)原子的作用能—鍵能;電子的能量;質(zhì)子運動的平動能;核內(nèi)粒子間的作用能——核能.
3、焙H大多數(shù)過程都伴有P,V變化,故定義:
H=U+PV同樣焙是狀態(tài)函數(shù),無法獲得絕對值,只需求焙變AH.
4、焙變AH的計算
焙變AH在數(shù)值上等與可逆過程的熱效應AH=Q可標準生成熱(焙),ArH9標準燃燒熱(焙),△.He


第3章化學平衡和化學反應速率
3.1、化學平衡


3.2、化學反應速率
化學反應速率的表示——反應進度
影響化學反應速率的因素

第4章溶液
4.1單相離子平衡
1、稀溶液的通性(依數(shù)性)只取決于溶質(zhì)的粒子數(shù)


3、溶度積規(guī)則——比較J與kOsp的大小
4、溶度積的應用
沉淀的生成、沉淀的溶解、沉淀的轉(zhuǎn)化
4.3配位平衡
1.基本概念配合物的組成配合物的命名
2.配離子的離解平衡
第5章電化學基礎
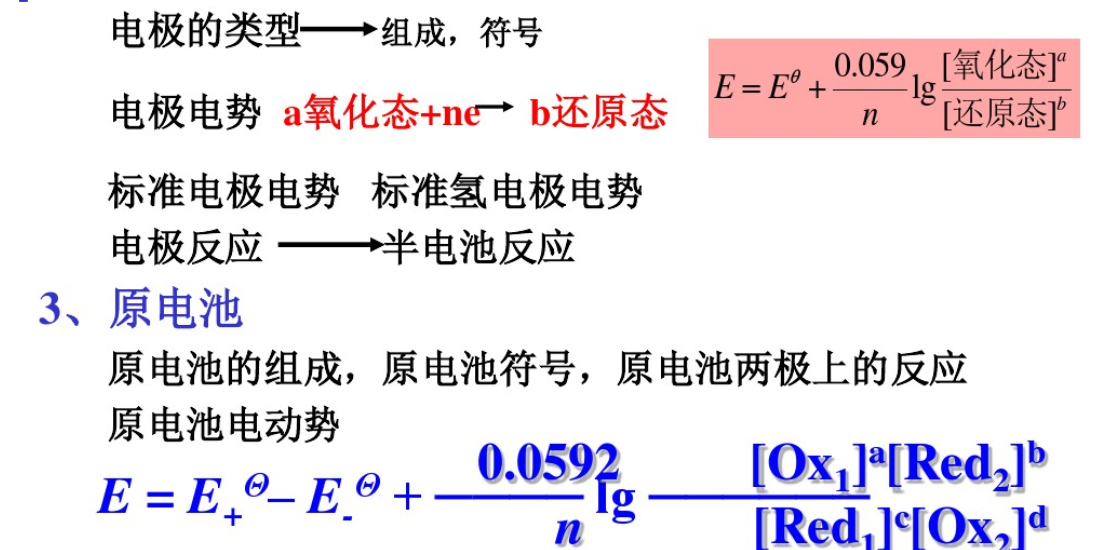
1、氧化數(shù),氧化環(huán)原反應的配平,半反應,還原電對。
2、電極