[最新考綱]
1.常見金屬元素(如Na、Mg、Al、Fe、Cu等)
(1)了解常見金屬的活動順序。
(2)了解常見金屬及其重要化合物的制備方法,掌握其主要性質(zhì)及其應(yīng)用。
(3)了解合金的概念及其重要應(yīng)用。
2.以上各部分知識的綜合應(yīng)用。
考點鈉及其重要化合物
1.下列各項說法或離子方程式書寫錯誤的是()A.(2017·高考全國卷Ⅱ,13B)將金屬鈉在燃燒匙中點燃,迅速伸入集滿CO2的集氣瓶,集氣瓶中產(chǎn)生大量白煙,瓶內(nèi)有黑色顆粒產(chǎn)生,由實驗現(xiàn)象可得到結(jié)論:CO2具有氧化性


2.(2016高考全國卷Ⅱ,12,6分)某白色粉末由兩種物質(zhì)組成,為鑒別其成分進(jìn)行如下實驗:
①取少量樣品加入足量水仍有部分固體未溶解;再加入足量稀鹽酸,有氣泡產(chǎn)生,固體全部溶解;
②取少量樣品加入足量稀硫酸有氣泡產(chǎn)生,振蕩后仍有固體存在。
該白色粉末可能為()

解析:選C。A項,樣品加入水NaHCO3溶解,再加入稀鹽酸Al(OH)3溶解,HC1與NaHCO3反應(yīng)放出氣體,但樣品加入稀硫酸,不會出現(xiàn)固體,A項錯誤;B項,樣品加入水NaHCO3溶解,再加入稀鹽酸AgCl不溶解,B項錯誤;C項,樣品加入水Na2SO3溶解,再加入稀鹽酸BaCO3溶解,產(chǎn)生氣體,而加入稀硫酸產(chǎn)生CO2和SO2的混合氣體,且生成BaSO4沉淀,C項正確;D項,樣品加入水均溶解,D項錯誤。
1.題型:選擇題
2.考向:鈉及其化合物在高考中較為重要,是每年高考都出題的知識點,以鈉及其化合物(特別是Na2O2、NaHCO3、NazCO3)的性質(zhì)為載體的推斷題或?qū)嶒烆}是主要的出題形式,Na2O2的結(jié)構(gòu)及反應(yīng)規(guī)律則是考查阿伏加德羅常數(shù)的重要題材,NaHCO3、Na2CO3則以涉及生產(chǎn)實際或?qū)嶒烆愒囶}中轉(zhuǎn)化推斷和計算類型的考查,在復(fù)習(xí)時應(yīng)予重視。
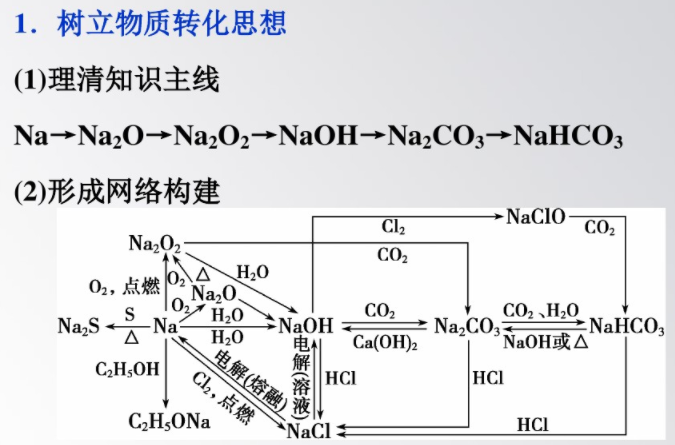
2.掃除易忘知識盲點
(1)鈉和鹽溶液反應(yīng),不能置換出鹽中的金屬,與熔融的鹽反應(yīng)才能置換出鹽中的金屬。
(2)無論Na與02反應(yīng)生成Na20還是Na2O2,只要參與反應(yīng)的Na的質(zhì)量相等,則轉(zhuǎn)移電子的物質(zhì)的量一定相等,但得到Na₂O2的質(zhì)量大于NazO。
(3)Na分別與H20和乙醇發(fā)生的反應(yīng)均屬于置換反應(yīng),二者現(xiàn)象明顯不同,前者劇烈,后者緩慢。
(4)1mol NazO2參與反應(yīng)轉(zhuǎn)移電子的物質(zhì)的量不一定為1
mol,如1mol Na₂O2與SO2的反應(yīng)轉(zhuǎn)移電子應(yīng)為2mol。
(5)不能用Ca(OH)2鑒別Na₂CO3和NaHCO3溶液,應(yīng)選用CaCl2或BaCl2溶液。
(6)除去CO2中的HCl氣體,應(yīng)選用飽和的NaHCO3溶液。
(7)向飽和的Na₂CO3溶液中通入過量CO2,有NaHCO3晶體析出。
(8)焰色反應(yīng)是元素的性質(zhì),無論游離態(tài)還是化合態(tài),均具有相同的焰色反應(yīng),它不是化學(xué)變化,在觀察鉀元素的焰色反應(yīng)時,應(yīng)透過藍(lán)色的鉆玻璃片。
(9)Na-K合金常溫下呈液態(tài),是原子反應(yīng)堆的導(dǎo)熱劑。
(10)周期表中從上到下堿金屬的密度呈現(xiàn)增大的趨勢,但K反常。
(11)Li和O2反應(yīng)只生成LizO;NaH是離子化合物,是一種強(qiáng)還原劑;Na20、Na₂O2中陰、陽離子個數(shù)比均為1:2。
題組一、鈉及其化合物的性質(zhì)和應(yīng)用1.化學(xué)知識在生產(chǎn)和生活中有著重要的應(yīng)用。下列說法中正確的是()
①鈉的還原性很強(qiáng),可以用來冶煉金屬鈦、鈕、釩、錯等
②K-Na合金可作原子反應(yīng)堆的導(dǎo)熱劑
③發(fā)酵粉中主要含有碳酸氫鈉,能使焙制出的糕點疏松多孔

解析:選A。①金屬鈉的還原性強(qiáng)于金屬鈦等,可以將金屬鈦、鈕、釩、錯等從其熔融態(tài)的鹽中置換出來,所以可以用來冶煉金屬鈦、鈕、釩、錯等,故正確;②K-Na合金熔點低,可作原子反應(yīng)堆的導(dǎo)熱劑,故正確;③碳酸氫鈉和酸反應(yīng)生成二氧化碳,所以發(fā)酵粉中主要含有碳酸氫鈉,能使焙制出的糕點疏松多孔,故正確;④Na₂O2和二氧化碳反應(yīng)生成碳酸鈉和氧氣,且又有強(qiáng)氧化性,有漂白性,所以Na2O2既可作呼吸面具中O2的來源,又可漂白織物、麥稈、羽毛等,故正確;⑤碳酸鈉堿性較強(qiáng),所以不能用來治療胃酸過多,碳酸氫鈉在醫(yī)療上是治療胃酸過多的一種藥劑,故錯誤;⑥明礬是強(qiáng)酸弱堿鹽,能水解生成氫氧化鋁膠體,膠體具有吸附性,所以可作凈水劑,但不能作消毒劑,故錯誤。
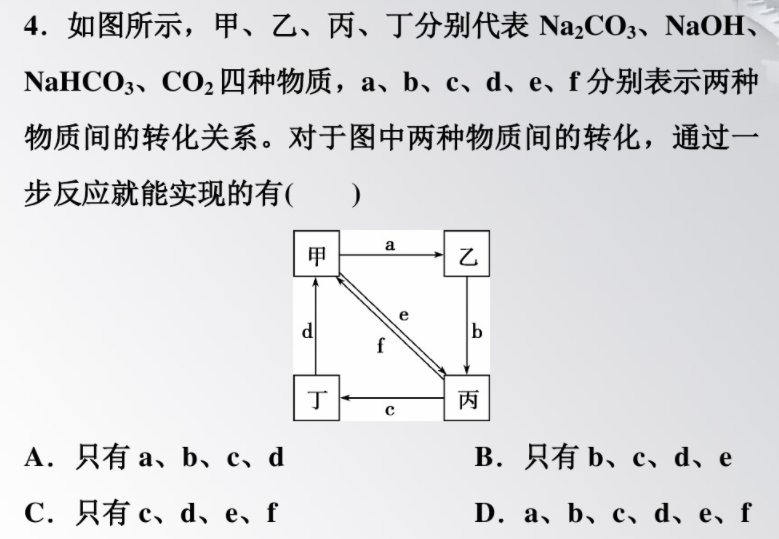
解析:選D。通過Na₂CO3與Ba(OH)2的反應(yīng),能夠?qū)崿F(xiàn)反應(yīng)a;向NaOH溶液中通入過量的CO2,能夠?qū)崿F(xiàn)反應(yīng)b;NaHCO3與酸反應(yīng)可以生成CO2,能夠?qū)崿F(xiàn)反應(yīng)c;CO2與NaOH反應(yīng)可以生成Na₂CO3,能夠?qū)崿F(xiàn)反應(yīng)d;Na₂CO3溶液中通入CO2,能夠?qū)崿F(xiàn)反應(yīng)e;NaHCO3受熱分解或與NaOH反應(yīng),能夠?qū)崿F(xiàn)反應(yīng)f。綜上所述,D正確。
考點2鎂、鋁及其重要化合物
1.判斷正誤(正確的打“√”,錯誤的打“×”)
(1)(2017·高考天津卷)用可溶性的鋁鹽和鐵鹽處理水中的懸浮物。(√)
(2)(2016·高考全國卷Ⅱ,13B)由MgC2溶液制備無水MgC2,可以將MgCl2溶液加熱蒸干。(×)
(3)(2016·高考全國卷Ⅲ,7A)根據(jù)Al2(SO4)3和小蘇打反應(yīng)的化學(xué)性質(zhì),在實際應(yīng)用中可用泡沫滅火器滅火。(√)
(4)(2016·高考江蘇卷)因為Al2O3熔點高,所以可用作耐高溫材料。(√)
(5)(2015·高考全國卷I,10C)用坩鍋鉗夾住一小塊用砂紙仔細(xì)打磨過的鋁箔在酒精燈上加熱,現(xiàn)象:熔化后的液態(tài)鋁滴落下來,結(jié)論:金屬鋁的熔點較低。(×)
(6)(2015·高考全國卷Ⅱ,13B)將濃硝酸滴在用砂紙打磨過的鋁條上,會產(chǎn)生紅棕色氣體。(×)
(7)(2015·高考全國卷Ⅱ,13C)將氯化鋁溶液滴入濃氫氧化鈉溶液中,會產(chǎn)生大量白色沉淀。(×)
2.[2017·高考全國卷Ⅱ,26(1)(2)(3)]水泥是重要的建筑材料。水泥熟料的主要成分為CaO、SiO2,并含有一定量的鐵、鋁和鎂等金屬的氧化物。實驗室測定水泥樣品中鈣含量的過程如圖所示: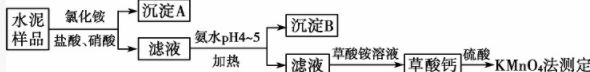
Mg、Al都是較活潑的金屬,常溫下能被空氣中的O2氧化,表面生成一層致密的氧化膜。鎂在純氧中劇烈燃燒,發(fā)出耀眼的白光。鎂不易和冷水反應(yīng),但能與沸水反應(yīng)。常溫下鋁在濃硫酸或濃硝酸中會發(fā)生鈍化,所以常用鋁槽車來運輸濃硫酸和濃硝酸。2.MgO是很輕的白色粉末,屬堿性氧化物,它能與水緩慢反應(yīng)生成Mg(OH)2;它具有很高的熔點,可作耐高溫材料。MgC12是一種無色、味苦、易溶于水的固體,易潮解,可作干燥劑。工業(yè)上用電解熔融MgCl2的方法制取金屬鎂。
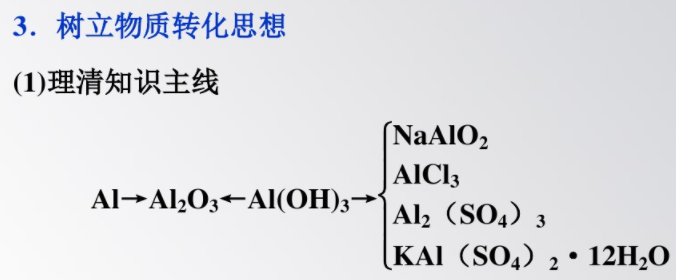
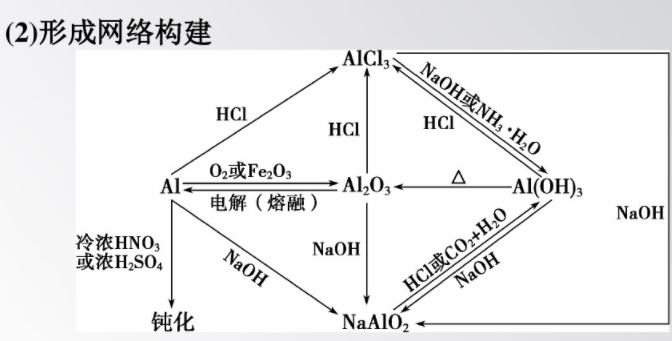
4.掃除易忘知識盲點
(1)鋁是活潑金屬,但鋁抗腐蝕性相當(dāng)強(qiáng),因為鋁表面生成一層致密的氧化物薄膜。由于Al203的熔點高于Al的熔點,故在酒精燈上加熱鋁箔直至熔化,發(fā)現(xiàn)熔化的鋁并不滴落。
(2)鋁熱反應(yīng)不僅僅是單質(zhì)鋁與Fe2O3反應(yīng),還包括制取其他難熔金屬的反應(yīng),由于鋁熱劑是混合物,故鋁熱反應(yīng)不能用于工業(yè)上冶煉鐵。注意鋁熱反應(yīng)是中學(xué)化學(xué)中唯一一類金屬單質(zhì)與金屬氧化物在高溫條件下的置換反應(yīng)。
(3)引發(fā)鋁熱反應(yīng)的操作是高考實驗考查的熱點,具體操作是先鋪一層KCIO3,然后插上鎂條,最后點燃鎂條。
(4)并不是Al與所有金屬氧化物均能組成鋁熱劑,該金屬氧化物對應(yīng)的金屬活潑性應(yīng)比鋁弱。
(5)Al2O3、Al(OH)3與NaOH溶液的反應(yīng)常用于物質(zhì)的分離提純。Al(OH)3不溶于氨水,所以實驗室常用鋁鹽和氨水來制備Al(OH)3。
(6)利用偏鋁酸鹽制備Al(OH)3,一般不用強(qiáng)酸,因為強(qiáng)酸的量控制不當(dāng)會使制得的Al(OH)3溶解。若向偏鋁酸鹽溶液中通入CO2,生成的Al(OH)3不溶于碳酸,CO2過量時生成HCO3,不過量時生成CO,書寫離子反應(yīng)方程式時要特別注意。
(7)Al(OH)3可用作抗酸藥;明礬常用于凈水。
(8)泡沫滅火器所用試劑為Al₂(SO4)3溶液和NaHCO3溶液。